突如其来的19新型冠状病毒给国人的新年蒙上了一层阴影,一时间,医生抢上阵,民众抢隔离,今天笔者也抢一微文,和大家聊聊冠状病毒检测技术。
针对冠状病毒的检测方法主要包括检测病毒相关蛋白或患者体内中和抗体的抗原-抗体法(主要为酶联免疫法)、检测病毒核酸的PCR法、病毒分离鉴定、芯片法等等,前两者在临床上具有较强的可操作性,应用也最广泛。酶联免疫法和PCR法均具有较高的检测准确率,二者配合使用则可获得更客观的临床诊断数据。但由于酶联免疫法试剂盒的研制需要病毒相关蛋白的体外表达、纯化及相应抗体的制备,研制周期相对较长。而核酸检测试剂盒的研制则更为快捷,只要知晓了病毒基因组序列,便可设计出相应的扩增引物,再与常规的PCR检测试剂包装成试剂盒便易如反掌。
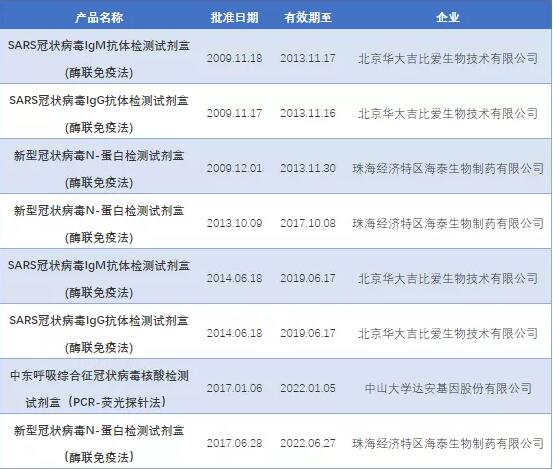
犹记03年时,媒体还没有如此发达,每天只能在电视新闻中听闻今天又新增了几例病例;技术也没有如此先进,临床诊断还主要是采用血常规结合X射线胸片的方法,误诊率较高。全球首个SARS病毒血清抗原检测试剂盒直至2003年的12月,也就是抗击非典结束后半年才姗姗来迟。笔者在国家药品监督管理局网站上查询到,从2003年到2018年15年间,仅有8款针对冠状病毒的检测试剂盒获批(表1),其中7款为国产酶联免疫试剂盒,1款PCR-荧光探针法核酸检测试剂盒。其中华大吉比爱生物技术有限公司的4款试剂盒检测对象是患者体内产生的SARS特异性IgM或IgG抗体,珠海经济特区海泰生物制药有限公司的2款试剂盒则是针对SARS病毒的N-蛋白进行检测。值得注意的是,针对当年SARS-coV检测的最早的一款试剂盒也是疫情过去4个月后才获批成功。
表1 2003-2018年获批冠状病毒检测试剂盒
(数据来源:国家药品监督管理局网站)
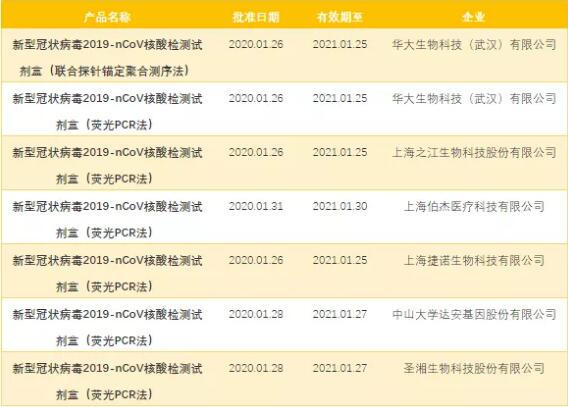
时光流转到2019年,当冠状病毒披着“新型铠甲”卷土重来时,短短1个月余的时间内国家药监局已审批通过了7款试剂盒(表2)。而已研制成功的试剂盒更是多达17种,涉及21家企业。体外诊断(IVD)公司的迅速反应,体现了我国在疾病检测领域的飞速发展。不仅如此,相关企业也在加足马力对2019-coV的相关蛋白进行体外表达纯化并积极推进着相关抗体的制备,预示着酶联免疫试剂盒也即将问世。
表2 2020年获批冠状病毒检测试剂盒
(数据来源:国家药品监督管理局网站)
相对于药物和疫苗,病毒检测技术普适性更强,看似更容易被攻克,但在具体应用层面,仍面临着许多个性的问题,如不同病毒的样本获取及核酸提取的差异、以及检测结果的偏差等。对于冠状病毒检测技术的研发现状如何,迅速推出的试剂盒是否意味着我们可以从容应对一切突发病毒的检测,以下将从专利大数据的角度,对我国及全球冠状病毒检测技术发展状况进行解读,以期为应对突发性疫情提供一些思路。
冠状病毒检测技术的研发属于“事件主导型”研发
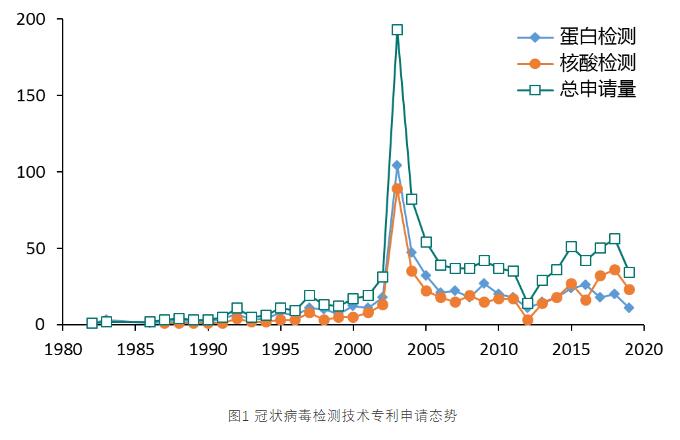
由图1可以看出,2003年“非典”疫情到来之前,学术届对于冠状病毒的检测并不十分关注,无论是蛋白检测,还是核酸检测,年均专利申请量在10件左右。而2013年SARS疫情席卷中国,冠状病毒专利申请也出现了爆发式增长,达到了近200件。而当疫情过后,专利申请量又呈现断崖式下跌。直至2015年,中东呼吸综合征(MERS)在韩国爆发,专利申请也相应出现反弹,但由于有了上一次疫情中的技术积累,专利申请量也没有增长太多。MERS疫情过后,相关专利申请量保持平稳状态。由于专利申请公开滞后,2018年后的专利申请量还不能反映实际数量,由于此次中国“新冠”疫情,预计2019-2020年的专利申请量还会出现一波增长。
在检测对象方面,从下图也可以注意到,2015年MERS疫情爆发之前,学界更多关注的是蛋白检测。而MERS疫情是个分水岭,之后核酸检测便占据了主导地位。本次“新冠”事件中,中国药监局审批通过的7个试剂盒也清一色均为核酸检测试剂盒。
冠状病毒检测技术属于小众研发领域
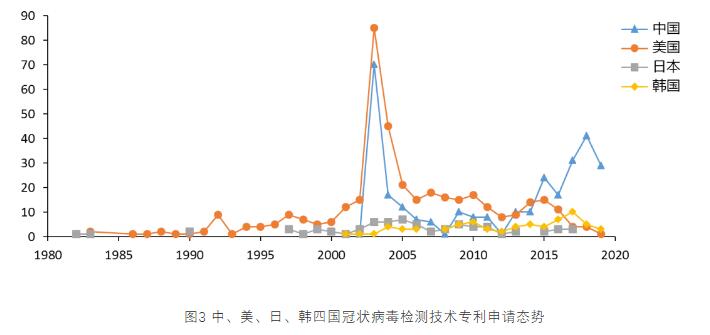
2003年前,冠状病毒检测的研究由美国、日本及欧洲的一些国家主导,主要为基础性研究,中国并未过多的参与其中,各国的申请量也很少。而2003年由于中国“非典”爆发,中国在冠状病毒检测方面的专利申请一跃成为全球第二,申请量占据全球的32%,仅次于美国,这对知识产权保护尚处于起步阶段的中国来讲实属不易,显示了中国学术界用科学打败疫情的决心。与此同时,受“非典”影响,亚洲的中国台湾、新加坡、中国香港等地区的专利申请量也跻身全球前列。“非典”过后,美国继续领跑,但各国的申请量都出现了断崖式下跌。虽然2004-2014这十年是分子生物学飞速发展的一段时期,新技术不断涌现,而美国也是绝大多数核心技术的发源地,如二代测序、抗体技术、基因编辑技术等,但对于冠状病毒检测的研发,并没有再出现过大幅的增长。2015年后,随着各类平台技术的不断成熟,新技术的开发进入平台期,而随着中国知识产权制度的不断完善,研发主体专利保护意识的不断增强,中国在各领域的专利申请量大幅增长,冠状病毒检测领域申请量也超越美国跃居全球首位。
放眼全球,美国长期处于研发领先地位。而由于前两次冠状病毒疫情均发生在亚洲,在2003年及之后后韩国和日本在病毒检测领域的专利申请量也在大幅增长,处于全球前五的位置。从绝对申请量来看,申请量最高的2003年,最多的美国也只有85件专利申请,相对于动辄年申请量上千件的肿瘤检测领域,实在是凤毛麟角。可见,冠状病毒检测技术一直以来就属于小众研发领域。
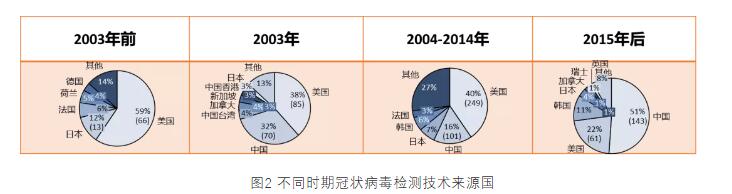
美国在冠状病毒检测研发领域起步于上世纪80年代,起步较早,且由于掌握众多核心平台技术,在该领域的专利申请量长期领跑全球,直至2015年被中国超越。中国比美国起步晚了近20年,但由于“非典”事件,能够在2年内跃居全球申请量第二,并在此后十余年间一直保持了这个地位。日本同样起步较早,且一直以来申请量保持平稳。韩国和中国起步时间相同,各年度的申请量与日本相差不多,在10件上下。
研发主体见招拆招,昙花一现
2003年前,冠状病毒的研究由美国主导,全球排名前五位的申请人也基本被美国申请主体占据。2003年,申请量前7位的申请人则均属于亚洲,其中中国占据5席,中国香港和新加坡各占1席。2004-2014年,中、美、韩三国的申请主体排名全球前列。2015年后,中国不仅在总申请量上跃居全球首位,在申请人排名上全球前7位中有6位中国申请人,而这份排名中也出现了基因编辑技术核心专利持有者——布罗德研究所有限公司的身影,预示着新的病毒检测技术横空出世。

纵观全球各个时期,并没有任何申请人能够长期稳居前列,且每个时期排名靠前的申请人的专利申请数量也均是个位数,冠状病毒检测领域呈现百花齐放、“你方唱罢我登场”的态势。这也显示了冠状病毒作为短时集中爆发式出现的病毒,并未引起任何一个研发主体对其检测方法进行持续性的投入研究,更多的是见招拆招式的应对式研究。
借力平台技术的发展稳步推陈出新
(1)2003年前——积铢累寸
早期的冠状病毒检测均是采用动物病毒进行的研究性开发。早在1983年,日本KACHIKU EISEI SHIKENJO JAPAN的专利申请JP1984218959A首次报道了牛冠状病毒的抗体检测方法。
2001-2002年,来自英国皇家兽医学院及美国辉瑞公司的科学家在体外表达了犬冠状病毒(WO2004011651A1)和猫冠状病毒的S蛋白(US20020115064A1),并提出了基于酶联免疫法检测犬冠状病毒和猫冠状病毒的方法。
也是在2001年,美国密歇根州立大学的专利申请US20050239057A1较早地报道了采用多重RT-PCR / PCR方法检测牛冠状病毒的方法,自此开启了冠状病毒核酸检测的大门。
(2)2003年——一触即发
2003年,“非典”在中国爆发,这一年的专利申请达到了179项,其中核酸检测89项,蛋白检测104项,检测技术方面也呈现多样化,多种分子生物学前沿技术被提出应用于冠状病毒的检测。
美国伟胜科技有限公司的专利US7629114首次提出通过将生理溶液引入结膜囊并收集排入口咽的灌溉来收集鼻咽标本的方法以收集鼻咽细胞和分泌物以诊断病毒性上呼吸道感染,大大提高了获取检测样本的便利性。
美国联合生物医学公司的专利申请US20050100883A1报道了采用SARS冠状病毒(SCoV)的膜糖蛋白(M),刺突糖蛋白(S)和核衣壳蛋白(N)作为包被抗原检测SARS相关抗体的酶联免疫测定(ELISA)方法。
日本荣研化学株式会社的专利申请WO2005001097A1提出了严重急性呼吸综合征(SARS)病毒高灵敏度且快速的检测方法,其根据SARS冠状病毒RNA聚合酶碱基序列设计引物,通过核酸扩增法对病毒进行检测。
美国基因耐克生物医学制品有限公司的专利申请WO2005038039A2公开了可以进行多重扩增反应的TempPCR方法,可实现对靶序列的敏感和特异性扩增。
香港YEUNG WAH HIN ALEX的专利申请US20040229211A1公开了使用一种染料(MOD)的多重实时PCR的敏感诊断测试方法及其在严重急性呼吸综合征(SARS)的应用。
广州万孚生物技术股份有限公司的专利申请CN1453589A公开了基于抗原抗体反应的胶体金层析法检测SARS冠状病毒抗原的试剂盒。
王虹的专利申请CN1455003A公开了分子信标法检测SARS冠状病毒,适用于定性、定量检测呼吸道分泌物、血清、病检组织和各种排泄物等标本中的SARS-Cov RNA。
(3)2004-2014年——风平浪静
从“非典”事件结束到MERS疫情到来前的2004-2014年间,分子生物学飞速发展,随着抗体制备技术的不断推陈出新以及二代测序时代的到来,冠状病毒检测技术也随着平台技术的发展而不断更新,但由于这个时期并无市场需求,专利申请多为探索性研究,集中于表位蛋白的分离表达以及对于病毒的高通量检测的尝试,涉及核酸检测193项,蛋白检测249项。
表位蛋白的成果分离表达即可用于病毒检测,又可用于疫苗制备。中国科学院上海生命科学研究院的专利申请CN101085812A公开了一种SARS冠状病毒多肽抗原,在临床诊断中具有应用价值。中国科学院武汉病毒研究所的专利申请CN101100680A公开了高效表达SARS冠状病毒S蛋白的重组杆状病毒CCTCC NO:V200703,在疾病诊断及疫苗生产等相关领域的重要应用价值。美国人力资源与健康服务部的专利申请WO2005010034A1公开了来自病毒(SARS-CoV)的刺突蛋白,可用于治疗和诊断。财团法人国家卫生研究院的专利申请 WO2005103259A1公开了SARS-cov核衣壳蛋白表位。
二代测序技术的出现使高通量核酸检测成为可能,大大提高了核酸检测的便利性。国家质量检验检疫总局动植物检疫实验所的专利申请CN103205509A公开了采用悬浮芯片技术的13种呼吸道病毒高通量检测方法,可对包括冠状病毒SARS-CoV在内的13中呼吸道病毒进行高灵敏度、高通量的检测。韩国基因特力株式会社的专利KR100625325B1公开了用于检测SARS病毒的N蛋白的引物和探针组合物。中山大学的专利申请CN102732638A公开了人冠状病毒OC43、229E、NL63、HKU1和SARS一管多重荧光PCR检测方法及其引物、探针和试剂盒,可实现对人冠状病毒五种型别的一管多重检测。
(4)2015年后——横空出世
2015年,MERS疫情在韩国爆发。有了前期的技术积累,核酸检测试剂盒得以迅速研制并应用于临床检测,在病人的诊断方面可以说比“非典”时期有了很大的进步。由于冠状病毒检测技术的成熟,虽然疫情再次来袭,专利申请量也没有出现大幅增长的情况。值得注意的是,2015年冠状病毒检测的专利申请人名单中,“布罗德研究所”的名字赫然在列。布罗德研究所的张锋研究员是真核细胞基因编辑技术的创始人,推动了基因编辑技术在2012年后飞速发展。布罗德研究所的专利申请WO2017040316A1的提出也正式宣告基因编辑技术登上了冠状病毒检测的舞台。
结语
由以上分析可知,各国研发主体对于冠状病毒检测技术并未投入很大的研发精力,技术发展更多借力于平台技术的发展及与相关RNA病毒的检测技术的相互借鉴而稳步推进。虽然本次“2019-coV”疫情中我们应对迅速,核酸检测试剂盒快马加鞭的被研制、审批、生产,但这些“赶制”出的试剂盒在实际应用中也是反响不一,通常需要几个试剂盒同时检测才能获得比较准确的结果,造成了一定程度上的资源浪费。
对于冠状病毒这类偶发性病毒,若长期大量投入研发,势必造成资源浪费,同时由于其自身危害性极大,研发活动也会受诸多限制,大面积铺开研发是不现实的。但虽然其他RNA病毒的检测方法具有可借鉴性,但毕竟也存在着冠状病毒检测中个性的问题,如由于样本的获取、运输、保存、引物特异性、检测方法本身、试剂盒质量控制等诸多因素造成的假阴、假阳性问题,又无法在短时间克服。因此,在未来的研发道路上,可采取合理分配研发资源,加强国际合作,必要时也可充分动员民间力量,如成立病毒研究基金会等措施,对冠状病毒核酸检测中检测样本的获取及质量控制、引物特异性、检测标准的完善、试剂盒质量控制,以及抗原-抗体检测方法中涉及的病毒蛋白的体外表达、抗体的制备等具体领域进行有针对性的研究,为从容应对突发疫情做足技术储备。

华智数创(北京)科技发展有限责任公司是中国专利技术开发公司的全资子公司,是国家知识产权局批准设立的国家专利导航项目(企业)研究和推广中心,是中国知识产权发展联盟发起单位、常务理事单位、知识产权大数据委员会牵头单位。

国家专利导航

华智数创
